文 | vb 动脉网
随着精准医疗与技术创新的不断演进,肿瘤药物研发正在经历深度重构。从靶点聚焦、疾病领域分布,到机构参与模式与技术路径,全球研究版图愈加清晰。特别是在 2025 年 AACR 年会公布的研究汇总分析后,核心趋势已逐渐呈现:传统靶点依旧强势,新兴靶标加速突破,机构分工更趋专业化,AI 技术全面渗透药物发现与诊疗预测环节。
本篇行业研究基于 AACR 2025 发布的全量摘要数据,系统梳理了全球肿瘤研发三大维度:(1) 疾病与靶点研究热点,(2) 机构类型与技术趋势,以及 (3)AI 在肿瘤研究中的融合应用。通过对 7100 余篇 AACR 2025 参会文章的内容归类与解析,本文旨在帮助读者快速掌握全球肿瘤研发的核心焦点、地区与机构间的差异化布局、前沿靶点的落地路径与 AI 技术赋能的实际场景。
全球肿瘤研究热点方向
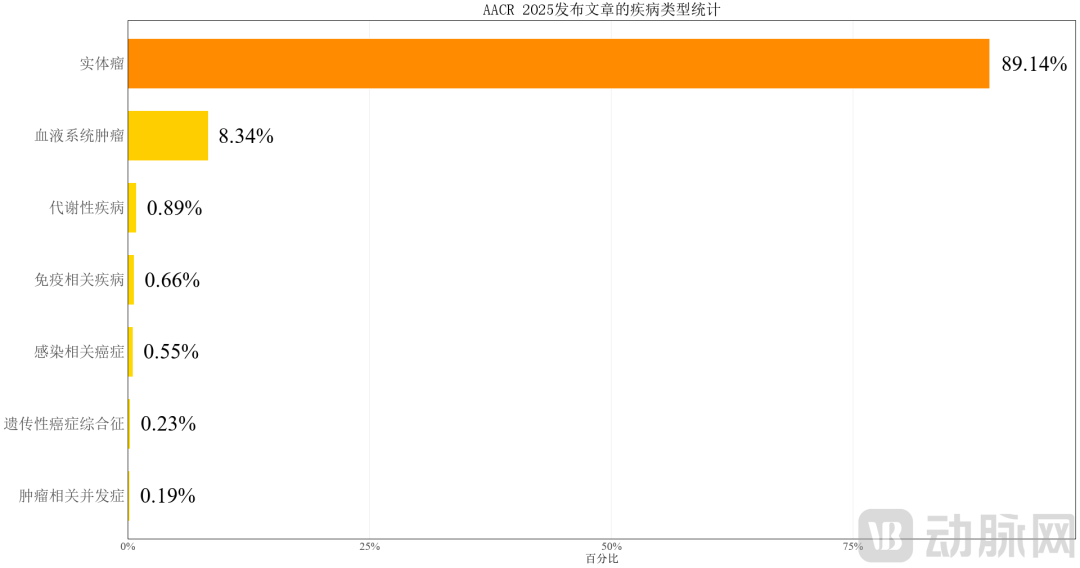
1.1 实体瘤为研究主战场,血液系统次之
根据 AACR 2025 年会公布的研究统计数据,实体瘤研究占比高达 89.14%,远超血液系统肿瘤 (8.34%) 及其他疾病类别 (如代谢性疾病 0.89%、免疫性疾病 0.66%)。这一研究格局与全球肿瘤负担相吻合。GLOBOCAN 2020 报告显示,肺癌、乳腺癌和结直肠癌等固态瘤种占新发癌症病例的 60% 以上,实体瘤仍是当前抗肿瘤药物开发和基础研究的核心领域。

来源:根据 AACR 2025 大会网站信息,医药魔方的数据整理
1.2 系统性肿瘤研究重心分布与临床负担吻合
对实体瘤进一步分类发现,乳腺及妇科肿瘤 (26.7%) 与消化系统肿瘤 (26.7%) 并列为研究比例最高的领域,其次为呼吸系统肿瘤 (16.1%) 和泌尿生殖系统肿瘤 (12.1%)。这与全球高发癌种排名基本一致,其中乳腺癌为女性最常见肿瘤 (占 11.7%),结直肠癌和肺癌紧随其后。
在血液系统肿瘤中,白血病研究占比达 52.8%,遥遥领先于淋巴瘤 (27.4%) 与浆细胞瘤 (15.4%)。近年来,CAR-T、BiTE 以及 Bcl-2 抑制剂等靶向策略的突破推动了白血病治疗手段的快速演进,呈现出细胞疗法与靶向药物双线并进的格局。
感染相关疾病领域,HPV 病毒致癌机制相关研究占据主导地位 (46.2%),远超 EBV 相关研究 (5.1%)。近年来研究焦点已由预防型 HPV 疫苗转向治疗性疫苗与免疫联合疗法开发,其在宫颈癌、头颈癌等肿瘤治疗中展现潜力。

来源:根据 AACR 2025 大会网站信息,医药魔方的数据整理
在代谢相关疾病中,研究集中于Ⅰ/Ⅱ型糖尿病 (36.4%) 与肥胖 (30.3%) 背景下的肿瘤易感性,其余如高胆固醇血症 (15.2%)、胰岛素抵抗 (6.1%) 研究占比相对较小。流行病学研究证实,肥胖和Ⅱ型糖尿病显著增加胰腺癌和结直肠癌的发病风险,提示代谢失衡是重要的肿瘤致病背景,亦为早筛与干预提供新方向。
免疫相关疾病研究中,自身免疫病 (41.3%) 与炎症性肠病 (IBD,23.9%) 最受关注。IBD 患者的结直肠癌风险是常人的 2 倍以上,慢性炎症对肿瘤微环境的重塑作用正成为研究热点。该类研究有助于进一步解析免疫调控与肿瘤发生之间的关联。在遗传性癌症综合征研究中,林奇综合征 (64.3%) 为最主要研究对象,其在结直肠癌和子宫内膜癌中的早筛与风险管理已纳入临床指南。遗传性肿瘤研究强调对高危人群的早期干预与个体化防控策略。肿瘤相关并发症研究则聚焦于治疗相关毒性 (71.4%),如细胞毒性、免疫不良反应等,远高于放射诱导性纤维化 (28.6%)。随着治疗技术的升级,并发症管理日益成为优化临床方案不可忽视的部分。

来源:根据 AACR 2025 大会网站信息,医药魔方的数据整理
1.3 癌种亚型精细化研究趋势明显
在乳腺及妇科肿瘤中,乳腺癌研究占比达 59.3%,为最主要研究方向,卵巢癌 (18.3%) 与三阴性乳腺癌 (TNBC,8.8%) 紧随其后。三阴性乳腺癌因缺乏激素及 HER2 靶点,正积极探索 T 细胞引导疗法与抗体偶联药物 (ADC) 策略。乳腺癌亚型研究逐步从分子分型向精准靶向与免疫联合推进。在消化系统肿瘤中,结直肠癌 (38.4%) 和胰腺癌 (32.1%) 为研究重点。胰腺癌因五年生存率低于 10%,被广泛视为“ 难治性实体瘤” 的攻坚方向;肝癌 (13.3%) 与胃癌 (9%) 研究关注亦不断升温。呼吸系统肿瘤以非小细胞肺癌 (NSCLC,45.5%)、肺腺癌 (13.1%) 及小细胞肺癌 (SCLC,12.2%) 为主要研究对象,EGFR 突变、ALK 融合等经典靶点持续受到关注。



来源:根据 AACR 2025 大会网站信息,医药魔方的数据整理
泌尿生殖系统肿瘤中,前列腺癌 (62.4%) 研究占比最高,肾癌 (15.1%)、膀胱癌 (13.9%) 次之。PSMA 靶向放射性治疗与 AR 螺旋酶抑制剂相关成果获得 FDA 优先审评资格,AR 与 PSMA 双靶点策略成为前列腺癌治疗焦点。此外,肉瘤、神经系统与头颈部肿瘤的研究各有聚焦,主要关注稀有靶点、特定分子变异及免疫相关机制。血液系统肿瘤依然以白血病 (49.6%) 与淋巴瘤 (25.3%) 为主,罕见亚型研究正在获得更多关注,推动治疗手段与生物标志物的进一步多样化与精准化。





来源:根据 AACR 2025 大会网站信息,医药魔方的数据整理
1.4 TOP10 靶点研究:“ 广谱核心+系统特异” 并进
消化系统肿瘤靶点覆盖传统驱动基因 (KRAS、EGFR、TP53)、免疫通路 (PD-1/PD-L1) 及关键信号通路 (PI3K/AKT、β-catenin),展现“ 靶向+免疫+信号通路联合” 的发展趋势。KRAS 为胰腺导管癌和结直肠癌的核心驱动基因,G12C 抑制剂 sotorasib 联合 panitumumab 方案已获 FDA 批准用于 KRAS G12C 突变的转移性结直肠癌。TP53 为最常突变的抑癌基因,突变率在消化系统肿瘤中显著偏高。PD-1/PD-L1 抑制剂在 MSI-H/dMMR 型结直肠癌中作为一线治疗已被证实有效,KEYNOTE-177 试验中 pembrolizumab 改善了生存期与耐受性。
肺癌聚焦 EGFR 和 KRAS 等传统靶点,同时引入免疫策略及新靶点 DLL3。第三代 EGFR TKI(如 lazertinib) 联合抗体 amivantamab 已获批,开启“TKI+抗体” 治疗时代。KRAS G12C 抑制剂在 NSCLC 中率先获批,并拓展至其他亚型。DLL3 为小细胞肺癌特异性靶点,双特异抗体和 CAR-T 疗法正在临床早期阶段展现潜力。


来源:根据 AACR 2025 大会网站信息,医药魔方的数据整理
泌尿生殖系统肿瘤以 AR 和 PSMA 为前列腺癌核心靶点,同时扩展至 PD-L1 和 Nectin-4。Pluvicto(PSMA 靶向放射配体) 已被批准用于 mCRPC。膀胱癌中 Nectin-4 靶向 ADC(如 enfortumab vedotin) 临床获益显著。乳腺与妇科肿瘤采用“ 信号通路+DNA 修复+免疫” 组合策略,HER2(23.9%) 与 ER(13.2%) 为两大核心靶点。


来源:根据 AACR 2025 大会网站信息,医药魔方的数据整理
罕见实体瘤聚焦免疫检查点与融合蛋白,尤文氏肉瘤的 EWS-FLI1 已成为关键候选靶点。PD-1(24.7%)、p53(12%)、CTLA-4(10.1%) 等位居研究前列。BRAF 在黑色素瘤中应用广泛,PD-1 与 CTLA-4 联合治疗已成为标准方案。神经系统肿瘤主要靶向 EGFR、p53、MGMT 及 IDH1,构建精准治疗组合。头颈部肿瘤则结合免疫靶点与病毒抗原,探索表观遗传路径。血液系统则聚焦 Bcl-2 调控、CD19/BCMA CAR-T 与双抗,以及 BTK/FLT3 信号通路。




来源:根据 AACR 2025 大会网站信息,医药魔方的数据整理
综上,p53 与 PD-1/PD-L1 在六大系统中均位列 TOP10,显示广泛的治疗适用性。KRAS 与 EGFR 在消化与呼吸系统中均为核心靶点,反映其在实体瘤中的共性机制。同时,各系统也呈现独特靶点:AR/PSMA 限于前列腺癌,EWS-FLI1 专属尤文氏肉瘤,MGMT/IDH1 聚焦神经系统,CD19/BCMA 聚焦血液肿瘤,HPV 抗原集中于头颈部肿瘤,明确揭示了肿瘤靶向治疗的“ 共性+特异” 结构。
1.5 见解:TOP3 系统肿瘤靶点分布与技术趋势
消化系统肿瘤 (胃肠、肝胆胰等):代表性靶点包括 EGFR、HER2、KRAS、BRAF、PI3K、VEGF 等传统靶点;新兴靶点如 Claudin18.2(柯德素 2) 和 GPC3 在胃癌、肝癌中受关注。例如,Claudin18.2 抗体 zolbetuximab 已获批用于胃食管腺癌,对应研究也在 AACR 等会议频繁报道。KRAS 突变 (尤其 G12C/G12D) 在胰腺癌和结直肠癌中高发,目前针对 KRAS G12C 的抑制剂已上市,而新型 G12D 抑制剂 (如 zoldonrasib、MRTX1133) 正显示出临床前和 I 期疗效。免疫检查点 (如 PD-1/PD-L1) 和新型 ADC 靶点 (如 HER2、TROP2) 也占据主要研究阵地。总体来看,消化道肿瘤靶向研发既延续了对 EGFR、HER2、KRAS 等传统靶点的关注,同时积极拓展 Claudin18.2、GPC3、FGFR2(胆管癌) 等新靶点的潜力。
呼吸系统肿瘤 (主要指肺癌):关键靶点包括 EGFR、ALK、ROS1、BRAF、MET、RET、KRAS 以及免疫靶点 PD-1/PD-L1 等传统目标;同时出现诸如 HER2 突变、NRG1 融合 (HER3 相关)、TIGIT、DLL3 等新靶点。典型案例是肺癌:第 3 代 EGFR 抑制剂 (如 lazertinib) 已与双特异抗体 amivantamab 联合获 FDA 批准;KRAS G12D 抑制剂 zoldonrasib 呈现初步临床活性;HER3 靶向双特异抗体 zenocutuzumab(针对 NRG1 融合肿瘤) 实现了临床突破。新药开发方面,研究重点正从传统 EGFR/ALK 等靶点拓展到 KRAS 变体、HER2/HER3 信号通路以及各种免疫通路的联合抑制。可见,肺癌领域的靶点分布呈现“ 老靶点加新靶点并行” 的趋势。
泌尿生殖系统肿瘤 (前列腺、膀胱、肾脏等):前列腺癌以雄激素受体 (AR) 为传统靶点,近期 PSMA(前列腺特异膜抗原) 放射性核素治疗获得 FDA 批准 (Pluvicto),展示了新靶点带来的治疗潜力。膀胱癌研究中,FGFR3 突变/融合常见,对应靶向药如 pemigatinib 获批;Ras/MAPK 和 PD-1 免疫靶点也在临床试验中占据重要地位。肾癌则以 VEGF/VEGFR(抗血管生成) 和 mTOR 路径为经典靶点,近年来对免疫检查点和新型靶点如 HIF-2α 抑制剂 (belzutifan) 等展开布局。总的来看,泌尿生殖系统肿瘤中,传统靶点仍主导 (如 AR、VEGFR、FGFR),但新靶点 (PSMA、HIF-2α、各种免疫检查点) 研究热度显著上升。
1.6 见解:传统 vs 新兴靶点:研发热度与创新潜力
传统靶点 (KRAS、EGFR、p53 等):这些靶点历经多年研究,目前在研发中仍占据主导地位。KRAS 家族是典型代表,近年来 G12C 抑制剂 (sotorasib、adagrasib) 成功上市,研究重心逐渐向 G12D 等其他变体转移。例如,zoldonrasib 作为首个口服 KRAS G12D 抑制剂,在 KRAS G12D 突变的 NSCLC 患者中取得了客观缓解;MRTX1133 在胰腺癌模型中诱导深度肿瘤退缩。EGFR 靶向仍是肺癌研究热点,新一代 EGFR 抑制剂联用双特异抗体方案已进入临床并获批。p53 作为经典肿瘤抑癌基因,其直接靶向仍具挑战性,当前更多研究集中在 p53 基因补偿疗法或相关通路 (如 MDM2) 的干预。在药企布局方面,大型制药公司持续推进这些经典靶点的升级药物和组合疗法,例如多靶点抑制剂和新型抗体偶联药物等。
新兴靶点 (BCMA、PSMA、CD19 等):这些靶点在近年研究中活跃度显著上升,创新潜力巨大。以血液肿瘤为例,BCMA 靶向治疗 (CAR-T 和双特异抗体) 已成为多发性骨髓瘤治疗的焦点。Roche/Poseida 开发的全新异体 CAR-T 产品 P BCMA ALLO1 在复发/难治 MM 患者中展示了 91% 总缓解率,显示出比单靶向更强的疗效。PSMA 靶向策略在前列腺癌表现亮眼,^177Lu-PSMA 放射性核素治疗 (Pluvicto) 已获准用于晚期转移性前列腺癌并正在拓展至一线应用。B 淋巴瘤靶点 CD19 则通过 CAR-T 和双靶 CAR-T 等新技术持续创新,合作开发的双抗 CD19/CD20 CAR-T 首次实现异体双靶 CAR-T 临床应用。这些新靶点的研究通常伴随着新型疗法平台 (如 CAR-T、双抗体、ADC、多特异抑制剂) 同步推进,使其在 AACR 等会议上成为讨论热点。此外,ADC、肿瘤疫苗、CRISPR 免疫治疗等技术趋势正在为传统和新靶点研究注入新动力,激发更多创新。
1.7 见解:TOP10 研究机构画像
AACR 2025 中排名前列的机构主要包括 MD 安德森癌症中心、Memorial Sloan Kettering(MSKCC)、Dana-Farber 癌症研究所、约翰霍普金斯大学、NCI/NIH 等。这些中心往往拥有多学科整合的平台和丰富的临床资源。例如,MSKCC 领导的免疫疗法研究组在错配修复缺陷 (MMRd) 实体瘤中报道了 PD-1 抗体 dostarlimab 的新辅助疗法,80% 患者完成治疗后无需手术;其团队还获得 AACR 奖项以表彰 MSK-IMPACT 基因测序平台的贡献。MD 安德森则在 PARP 抑制剂联合免疫疗法、数字孪生模型等领域持续发力,本次报告了针对 BRCA 突变患者的 PARP+PD-1 组合试验早期数据。Dana-Farber 在头颈癌、肺癌和乳腺癌等多种疾病中保持领先地位,重点研究方向包括 HPV 阴性头颈癌的新辅助免疫治疗、KRAS 突变肺癌联合通路抑制以及乳腺癌抗耐药联合方案等。以上机构的共同优势在于强大的科研实力、多中心临床试验网络以及跨学科合作 (如免疫学、基因组学与临床研究结合),使其在 AACR 发文中表现突出。








来源:根据 AACR 2025 大会网站信息,医药魔方的数据整理
研发机构类型、地区与创新分布
2.1 机构类型与地区:大学领跑,北美为重心
在 AACR 2025 大会披露的研究数据中,高校机构占据主导地位,占比达 35.6%,凸显其在基础研究与创新路径探索中的重要作用。企业和医院分别占据 22.9% 和 22.5%,体现出产业转化和临床验证作为肿瘤研发核心驱动的双轮结构。独立研究机构占比 16.3%,展现其在方法学、平台开发与基础生物学中的支撑性角色。
从地区分布来看,北美以 57.5% 的占比稳居全球肿瘤研究高地,其中美国的研究机构公布研究数量超过 4700 多份,远超全球其他国家,稳居全球第一;亚洲 (21.9%) 与欧洲 (17.5%) 紧随其后,中国以 758 的公布数量占据全球第二,其后是韩国 388;英国、法国、德国、西班牙和意大利均位列全球前十,是欧洲癌症研究关注度和投入较高的区域,与当地的人口体量具有较强的相关性。相较之下,大洋洲 (1.3%)、南美 (1.0%) 及非洲 (0.9%) 占比较低,提示肿瘤研究在全球尚有地域拓展与合作潜力。



来源:根据 AACR 2025 大会网站信息,医药魔方的数据整理
2.2 药物品种研发趋势:抗体与小分子双核驱动,新体系加速拓展
大学、企业、医院与独立研究机构在肿瘤药物研发路径上呈现“ 双核 (小分子+大分子) 主导、平台技术融合” 的共性框架,并在具体布局上各具特点。高校倾向于以小分子为主 (占比约 40%),其中约 30% 集中在 TKI 与传统靶向药,另有 25% 左右聚焦于 ADC、双抗、PROTAC 与 AI 辅助筛选等前沿平台,体现其基础研究与技术验证双向优势。企业则呈现出“30% 小分子+20% 抗体+20%ADC+10% 免疫检查点” 四足并进结构,同时在靶向蛋白降解与放射性配体等新兴机制 (10%) 方面快速推进商业化。医院机构更聚焦临床应用,抗体药物 (25%) 与免疫调节剂 (15%) 布局靠前,搭配小分子 (30%) 与细胞/基因疗法 (10%),体现其对一线治疗与 CAR-T 平台的双重重视。研究机构中,“ 其他” 创新平台 (占比约 35%) 居首,其次为小分子 (30%) 和 ADC(15%),更偏重高通量靶点筛选与机制创新。
整体来看,四类机构在稳固传统路径的同时,正加速布局多模态、跨平台的新兴疗法,显示肿瘤药物研发正向“ 靶点+平台” 双驱动战略演进。
正在上传图片

来源:根据 AACR 2025 大会网站信息,医药魔方的数据整理
2.3 各类机构聚焦的 TOP10 靶点分析
在靶点选择上,PD1、PDL1、EGFR、HER2、KRAS 与 p53 为各类机构共同关注的核心靶点,反映免疫检查点与驱动突变位点在肿瘤治疗中的长期战略地位。大学倾向于围绕 MYC、AR、Akt、PI3K 等基础生物学靶点进行探索,突出其在信号转导、细胞周期和内分泌肿瘤机制研究中的学术深度。企业则集中于 CD3、TROP2、CTLA-4 等免疫靶点,布局双抗、CAR-T、ADC 等商业潜力明确的新兴治疗形式。医院更关注 CDKN2A 等与患者分型和临床转化密切相关的靶点,体现其桥接基础与临床的优势。研究机构则重点发力 Ras、Akt 等信号通路关键节点,强化对肿瘤依赖机制的机制性解析与早期验证。




来源:根据 AACR 2025 大会网站信息,医药魔方的数据整理
2.4 全球 TOP20 MNC 的研发趋势
全球 TOP 20 跨国药企 (MNC) 在药物类型方面,小分子药物仍为主导 (33%),但大分子 (19.7%) 及技术驱动类药物 (7.1%) 比例持续上升,体现出研发模式由传统单一平台向多技术耦合的方向演进。在疾病布局上,消化系统肿瘤、乳腺及妇科肿瘤、呼吸系统肿瘤为三大重点领域,分别占 18%、18% 和 16.6%,对应全球肿瘤负担高发趋势。在靶点选择上,PD1、EGFR、PDL1、HER2 的高频布局 (分别为 22、19、18 和 14 次) 验证其在免疫+靶向双线战术中的核心地位。

表:全球 TOP20 MNC 公司名单 来源:根据美国 《制药经理人》 公布信息整理



来源:根据 AACR 2025 大会网站信息,医药魔方的数据整理
在代表性药物方面,罗氏的选择性 ER 降解剂 giredestrant(用于 HR+/HER2– 乳腺癌) 进入 III 期;阿斯利康的 HER2-ADC Enhertu、Imfinzi 在乳腺和肺癌中不断拓展适应症;诺华的放射性配体疗法 Pluvicto(靶向 PSMA) 在前列腺癌中改善疗效并已上市。此外,强生的 EGFR/MET 双抗 Rybrevant 联合方案和辉瑞的 BRAF 抑制剂 Braftovi 也体现出靶点协同策略的临床价值。在新兴技术平台方面,Arvinas 的 BCL6 靶向 PROTAC(ARV-393) 进入 I 期临床,BMS 的 AR 降解剂 CC-199 正在临床前推进;CRISPR 基因编辑疗法 Casgevy(由 Vertex 与 CRISPR Therapeutics 联合开发)2023 年在英国获批上市,成为首个 CRISPR 肿瘤疗法产品,代表靶点治疗正迈入基因级干预新阶段。此外,多家药企在 CAR-T、ADC 以及靶向蛋白降解平台上的联合探索,正重塑下一代肿瘤治疗范式。
2.5 中国 TOP20 药企的研发趋势
中国头部药企近年来快速崛起,展现出“ 生物制品主导+新兴技术突破” 的研发格局。统计显示,其在药物类型上对大分子药物 (抗体、融合蛋白等) 投入占比高达 65%,形成对单抗、双抗、ADC 等产品形态的研发优势;靶向蛋白降解类药物比例达 15%,显示出在新机制药物方面的积极布局,尤其是在 PROTAC 和分子胶方向开始具备一定储备。在适应症选择上,消化系统肿瘤、乳腺及妇科肿瘤、呼吸系统肿瘤并列为重点关注方向,均占比 24.1%,贴合国内肿瘤发病谱的高发趋势。在靶点层面,EGFR 和 PD-L1 分别被提及 4 次和 2 次,反映出对经典靶点的持续关注。

表:TOP20 中国制药公司名单 来源:根据搜狐医药, 美国 《制药经理人》,上市公司财报信息整理


来源:根据 AACR 2025 大会网站信息,医药魔方的数据整理
近年来,中国药企不断提升原始创新能力。以恒瑞医药为例,其 HER2-ADC SHR-A1811 已被纳入国家突破性治疗品种名单,并拥有 10 余个差异化 ADC 项目处于临床阶段。华东医药则聚焦胃肠道肿瘤抗原,如 CDH17/CLDN18.2 双靶点 ADC VBC108 展现出双通路协同激活潜力。在免疫治疗方面,国产首个 PD-1/CTLA-4 双抗“ 卡度尼利单抗” 已上市,标志国产免疫联合策略进入成熟应用阶段。PD-1 单抗方面,君实生物、信达生物等头部企业已构建稳定管线;此外,融合蛋白 (如艾加莫德α) 和 CAR-T/ADC 项目也在“ 国产替代” 逻辑下快速推进。根据医药魔方数据统计,2016–2023 年间,中国 TOP20 药企累计获批新药 88 款,其中 64% 聚焦肿瘤,41% 为自主研发,59% 通过引进与合作完成。这表明在满足国内市场需求的同时,中国药企正通过国际合作与平台搭建,向更高水平的原始创新迈进。
2.6 TOP20 国际科研机构的研究趋势
全球领先科研机构展现出药物研发平台化、多样化的策略特征。在药物类型方面,小分子与大分子药物分别占比 30.7% 和 10.8%,技术驱动类 (如蛋白质降解、递送系统) 占比 7.2%,免疫调节剂与细胞/基因疗法分别为 6.6% 和 6.2%,形成以靶点机制研究为核心、以平台融合为方向的多模态布局。在疾病关注上,消化系统肿瘤 (22.2%)、乳腺及妇科肿瘤 (19.7%) 与呼吸系统肿瘤 (12.1%) 位列前三,反映出科研机构在贴合流行病学趋势的基础上,优先布局高发高致死性瘤种。在靶点层面,PD1 与 p53 并列为最常被研究靶点 (均被提及 46 次),凸显其在免疫微环境与基因稳定性机制研究中的基础性地位。

表:全球 TOP20 科研机构 来源:根据 《新闻周刊》 和 Statista 公司公布的全球权威肿瘤治疗机构的信息整理



来源:根据 AACR 2025 大会网站信息,医药魔方的数据整理
2.7 TOP20 中国科研机构的研究趋势
中国顶尖科研机构在肿瘤药物研究中同样呈现出平台多元、机制深化的趋势。在药物类型上,小分子仍占主导地位 (28.5%),大分子 (16.3%) 与细胞/基因疗法 (6.5%) 占比逐年增长,反映出对前沿治疗手段的快速采纳。在疾病布局上,消化系统肿瘤 (21.7%)、乳腺及妇科肿瘤 (19.7%) 和呼吸系统肿瘤 (12.8%) 依然是主力方向,研究聚焦与国际趋势保持一致。在靶点选择方面,PD-L1 与 EGFR 并列第一 (均被提及 10 次),显示出对免疫检查点和经典驱动基因的持续兴趣与深入研究。

表:中国 TOP20 科研机构 来源:复旦大学医院管理研究所发布的 《2023 年度中国医院排行榜》 和 《2024 年度中国卫生健康统计年鉴》 的信息整理



来源:根据 AACR 2025 大会网站信息,医药魔方的数据整理
见解:国际与中国头部科研机构靶点研究趋势分析
国际科研机构广泛应用 CRISPR 筛选、多组学集成与人工智能辅助识别,推动新靶点发现体系化发展。英国 Wellcome Sanger 研究所联合 EMBL-EBI 发起的“ 癌症依赖性图谱” 项目,通过对 20,000 基因进行 CRISPR 敲除筛选,在 300 余个癌症模型中建立靶点优先级评分体系。NCI 主导的 CPTAC 项目通过蛋白质组+转录组一体化分析,已发现超 2800 个潜在可成药靶点。AI 也被广泛用于分子网络建模与靶点预测,在精准治疗策略中发挥基础作用。这类成果多以开放数据共享形式发布,并通过 Open Targets 等联盟促进产业界转化。
中国科研机构亦快速引入上述工具体系,部分团队已系统性开展 CRISPR 筛选、单细胞转录组测序与 AI 辅助药靶预测工作。政策层面,《国家重大新药创制专项》 推动“ 临床-实验室-企业” 三位一体协同攻关,CPTAC 数据库等国际资源也逐步向国内开放,助力靶点资源共享与本地化挖掘。
2.8 共性与差异:全球与中国研发布局比较
共性方面,全球与中国科研机构在靶点聚焦和平台技术上方向趋同,广泛研究 PD-1/PD-L1、EGFR、HER2 等核心靶点,并采用 ADC、双抗、细胞治疗等多种形式落地药物创新;均积极引入蛋白质组学、AI 算法与 CRISPR 筛选等技术手段,推进基础研究向药物开发的高效转化。
差异方面,国际头部科研机构与药企依托全球资源,更早布局如 KRAS、BCL6、SMARCA2/4 等高壁垒靶点,并向 PROTAC 与 CRISPR 疗法等未来技术延伸。中国机构起步聚焦“ 国产替代” 路径,以 PD-(L)1 等成熟靶点切入,近年转向 CDH17、GPC3 等差异化抗原及 AI 靶点筛选探索,形成“ 国产可及+局部突破” 的组合策略。此外,跨国企业推动全球同步开发,而中国团队则以本地市场为核心,逐步对接国际标准与临床试验网络。
总体而言,中外研发体系在靶点布局和技术采纳上日趋融合,但在策略上各有侧重:国际机构重体系化与广度,中国团队则以速度与灵活机制加速差异化创新,构建“ 追赶+突围” 的双路径体系。
AI 赋能肿瘤研究的全球格局
3.1 地区与机构画像

在 AACR 2025 大会展示的研究中,人工智能 (AI) 已成为推动肿瘤学精准化发展的重要技术引擎。总体来看,美国在 AI 肿瘤研究中保持绝对领先地位,共计发布 113 篇相关摘要,占全球总量超过一半,延续了其在传统靶点开发与机构产出中的主导态势。韩国 (23 篇) 与英国 (15 篇) 分列第二与第三,体现出亚洲和欧洲国家在 AI 医疗技术方面的政策支持和研发投入日益加强。中国以 11 篇排名第四,相较其在传统肿瘤研究中占据的区域份额 (亚洲 21.9%),在 AI 领域仍有广阔提升空间。
机构方面,美国国立癌症研究院 (NCI, 8 篇) 和芝加哥大学 (7 篇) 为 AI 肿瘤研究产出最多的机构,其在传统免疫靶点研究中的高活跃度亦有所延续。MD Anderson 癌症中心和三星医疗中心则体现出临床型机构在数据驱动医学中的多模态融合能力:前者建立肿瘤学数据科学研究所 (IDSO),开发基于深度学习的 HER2 自动评分系统和肺癌预后 AI 模型,后者则联合 KAIST 构建 AI 数字病理平台,并推进多模态影像学研究,覆盖呼吸、消化系统等核心疾病领域。这些机构的共同特点是拥有高度结构化的医疗数据和多学科协作机制,为 AI 模型的临床转化提供坚实基础。


来源:根据 AACR 2025 大会网站信息,医药魔方的数据整理

表:头部机构近 3 年内 AI 研发布局案例 来源:根据 AACR 2025 大会网站信息,National Cancer Institute, Pubmed 和机构网站信息整理
3.2 疾病领域聚焦
疾病研究方面,AI 应用聚焦于高发癌种:呼吸系统肿瘤居首 (25.8%),与传统研究中 NSCLC 的高热度 (16.1%) 相契合;消化系统肿瘤 (21.5%) 与结直肠癌、胰腺癌等高突变负荷肿瘤关联紧密;乳腺及妇科肿瘤 (13.5%) 虽略低于传统研究占比 (26.8%),但已有 HER2 表达评分等 AI 辅助系统临床落地,表明该领域 AI 应用仍处于加速渗透期。


来源:根据 AACR 2025 大会网站信息,医药魔方的数据整理
3.3 AI 研究靶点特征
靶点层面,AI 研究对 EGFR 与 PD L1 的关注度最高 (均 15.4%),与第二、第三部分中统计的传统研究热点高度吻合,显示 AI 工具正用于增强这些经典靶点的表型识别与疗效预测能力。AI 在 HER2 与 KRAS(各 12.8%) 的应用中亦表现活跃,特别是在肺癌和结直肠癌中,深度学习模型被用于非侵入性预测基因突变状态。此外,免疫相关靶点如 CD3(10.3%)、MHC I(7.7%) 的显著上升,标志着 AI 在肿瘤免疫微环境建模与抗原呈递机制探索中的扩展能力。少见靶点如 DLL3(5.1%) 的出现,提示 AI 正被用于罕见靶标的发现与亚群识别,支持新兴疗法如 BiTE 或 CAR-T 的早期开发。

表:TOP10 靶点的 AI 研发案例 来源:根据 AACR 2025 大会网站信息,PMC 和 Pubmed 文献库信息整理
综上所述,AI 在 AACR 2025 肿瘤研究中的布局已深入至主流机构、核心靶点与高发癌种的多个层面。当前的 AI 模型主要整合多组学数据、病理影像与临床信息,以实现复杂生物特征和分子表型的定量评估,对疾病特征进行分层预测,同时推动多模态数据交叉学习与智能协同。相较传统方法,AI 赋能正使肿瘤的疗法和药物研发向“ 精准靶点发现+临床智能匹配” 的方向升级,其在肿瘤的早期预测、患者筛选和精准治疗等环节的渗透将重塑未来肿瘤临床研究和药物开发模式。
综上,全球肿瘤药物研发已步入“ 靶点+平台+智能” 的三轴驱动时代。从实体瘤主导的靶点格局,到跨国药企与科研机构在新技术平台上的差异化尝试;从中国药企的国产替代到逐步崛起的创新靶点突破,再到 AI 技术对经典与新兴靶点的赋能重塑,2025 年肿瘤研究生态已呈现出系统性变革特征。
未来,靶点的“ 泛系统性” 与“ 系统特异性” 将共构临床策略主线;机构协作将加速从基础研究到转化应用的闭环效率;AI 与多组学融合将成为肿瘤研究不可或缺的计算引擎。本研究报告希望为业界提供一份扎实的数据分析与趋势解读,助力各类主体在靶点选择、技术规划与国际协同中的前瞻决策与战略落位。
更多精彩内容,关注钛媒体微信号 (ID:taimeiti),或者下载钛媒体 App