[ad_1]
文 | 氨基观察
当行业竞相寻找 「下一个 PD-(L)1」 时,PD-L1 ADC 却用创新机制证明:破局答案,或许就藏在 PD-(L)1 靶点本身。
辉瑞对 PD-L1 ADC 寄予厚望,接连押注 2 款 PD-L1 ADC;以复宏汉霖为首的国内药企猛踩油门,希望弯道超车。
在 2025 年 ASCO 大会上,PD-L1 ADC 也确实带来了惊艳表现,对于 PD-(L)1 耐药甚至更多经化疗、TKI 治疗失败的患者仍能展现出色的治疗效果,且市场顾虑的安全性良好。
更重要的是,PD-L1 ADC 进展并不慢,复宏汉霖的 HLX43 已经开展 2 期临床,辉瑞的 PF-08046054 正在开展 1 期,宣布计划在下半年启动 3 期临床。
种种迹象表明,PD-L1 ADC 的好戏开场了。
当 PD-L1 遇上 ADC
PD-L1 遇上 ADC,可能不一样。
在 ADC 大爆发崛起前,PD-L1 抑制剂已凭借独特机制大放异彩。罗氏、阿斯利康等企业,均推出销售额可观的抗 PD-L1 单抗药物。
这一现象不难解释。PD-L1 作为泛肿瘤靶点,在非小细胞肺癌、鳞状细胞癌、结直肠癌、三阴性乳腺癌、黑色素瘤等癌种中均有表达——部分瘤种阳性率 (高表达+中低表达) 超过 50%,在肺癌中更高达 70%,且在正常组织中表达有限。
这种特性使得 PD-L1 抑制剂可通过精准结合的方式,发挥双重机制。一方面,其通过结合肿瘤细胞表面 PD-L1,阻断 PD-1/PD-L1 通路,解除 T 细胞的活化和增殖抑制,恢复肿瘤特异性 T 细胞的杀伤功能;另一方面,PD-L1 抑制剂还能阻断肿瘤细胞表面 PD-L1 与抗原呈递细胞 (APC) 表面 B7-1 的结合,进一步激活 T 细胞免疫应答。
清晰的作用机制,让 PD-L1 抑制剂在肺癌等领域表现强势。而 ADC 药物 「精准化疗」 的特性,有望为 PD-L1 靶点开发注入新动能。
如上文所述,PD-L1 的广谱表达且正常组织低表达的特点,从逻辑上契合 ADC 药物开发需求。同时,多项研究证实,PD-L1 抑制剂可以在肿瘤细胞中可内化,这一特性使 PD-L1 ADC 的有效载荷能被递送至细胞内靶点,并最终在细胞内释放。
种种有利条件表明,借助抗 PD-L1 抗体递送毒性载荷,或能实现 「1+1>2」 的协同效应。
以 HLX43 为例,其兼具 ADC 靶向杀伤与 PD-(L)1 免疫检查点抑制的双重机制:毒素可通过靶点内吞进入肿瘤细胞并释放,再借助肿瘤微环境中的旁观者效应进入邻近肿瘤细胞,阻断 DNA 复制并诱导细胞凋亡;同时,其 PD-L1 靶向抗体可激活免疫调节机制,进一步增强抗肿瘤效应。
当然,任何药物研发都并非一帆风顺。目前全球 PD-L1 ADC 玩家有限,主要顾虑集中于该靶点的广谱表达可能引发的毒性问题,以及部分瘤种中 PD-L1 表达量不足等挑战。
而这些顾虑能否被打消,将决定 PD-L1 ADC 能否打开新战局。从在研的产品来看,结果相对乐观:上述问题还是能够通过 ADC 分子的设计来规避的。
理想照进现实
疗效突出、安全性良好,PD-L1 ADC 探索者们目前展现了相对积极的结果。
寻找下一个 PD-(L)1 的目的非常明确,旨在克服现有疗法的三大不足:第一,受到 PD-L1 表达水平的限制,响应比例有限;第二,在有响应的群体中,患者治疗深度有待提升;第三,无法避免耐药问题,需要寻找新的解决方案。
目前,在耐药群体市场中,PD-L1 ADC 们已展现出可观的战斗力。例如,辉瑞 PF-08046054 在今年 ASCO 上的数据显示,在几乎所有接受 PD-L1 治疗的复发非小细胞肺癌患者中,客观缓解率 (ORR) 依然有 27%。
HLX43 的战斗力似乎更加强悍,高效低毒是其最大特征。
在今年 ASCO 会议上,复宏汉霖带来了 HLX43 的 1 期研究最新结果。该研究分为两部分:Phase 1a 探索经历剂量限制毒性 (DLT) 的受试者比例以及最大耐受剂量 (MTD),Phase 1b 的主要终点是推荐的二期剂量和 ORR。
结果方面,Phase 1a、Phase 1b 均显示高 ORR 且带来 PFS 获益的趋势。
其中,Phase 1a 纳入了 21 名不同癌种的患者,中位既往治疗线数为 2,最终 ORR 为 36.8%,mPFS 为 4.2 个月;Phase 1b 中 21 名 「标准治疗难治」 的 NSCLC 患者 (中位既往治疗为 3 线,全部接受 IO 治疗失败,部分出现脑转移、肝转移,基线较差) 的 ORR 为 38.1%,DCR 为 81%,mPFS 为 5.4 个月。
亚组数据,让医学界对 HLX43 的未来更加乐观。
Phase 1a 中,而在相对罕见的胸腺鳞癌 (TSCC) 这一适应症上,HLX43 则带来了新的惊喜,对于这一占据胸腺癌 70% 左右的恶性高侵袭性肿瘤,现存的后线治疗方案都尚存在较大用药限制,或副反应严重,或疗效不明显,现存疗法客观缓解率仅有 25%,或针对特定人群,而 HLX43 在 4 例 TSCC 患者中,达到了 75%(3/4) 的 ORR,也就是 3 倍疗效的提升,未来或将在这一领域取得突破性疗效。
Phase 1b 中,无论是鳞状 NSCLC,还是非鳞状 NSCLC,HLX43 都展现了出色的疗效。
其中,15 名鳞状 NSCLC ORR 达到 40%,DCR 为 73.3%,同剂量下的非鳞状 NSCLC 患者也达到了 33.3% 的 ORR 和 100% 的 DCR。
在 4 线及更后线治疗的 NSCLC 人群中,HLX43 也取得了 38.5% 的 ORR,所有 (100%) 脑转移的 NSCLC 患者均得到了疾病控制,足以看出其治疗潜力。
尽管这一数据已经足够出色,但未来可能继续被刷新高度。因为 Phase 1b 共有 3 个剂量,分别是 2mg/kg、2.5mg/kg 或 3mg/kg,目前只是读出了最低剂量组的疗效,高剂量组效果可能更惊艳。
疗效突出的同时,HLX43 的安全性可控。
虽然 Phase 1a、1b 所有患者均经历了治疗相关不良事件 (TEAEs),但大多数为 1-2 级。Phase 1a 中,仅 4 mg/kg 剂量组中 1 名患者经历了发热性中性粒细胞减少症和白细胞计数减少的 DLTs;≥3 级的不良事件发生在 6 名 (28.6%) 患者中。
另外,Ib 期 2mg/kg 剂量组常见 3 级及以上的不良事件中,未见 (0%) 血小板、中性粒细胞减少等,且贫血和淋巴细胞减少仅占 14.3%,表明 HLX43 的血液毒性可控。
上述数据表明两点。第一,市场担心的 PD-L1 广谱表达可能引发的毒性问题是多虑的;第二,低血液毒性表明 HLX43 的毒素在血液中稳定性好,为后续的更多临床研究的开展和联合用药奠定了关键的安全性基础。
结合疗效和安全性来看,PD-L1 ADC 在耐药群体中已经足够让人期待。未来,PD-L1 ADC 可能突破 PD-L1 表达限制,触及更广泛的实体瘤患者。
此前,HLX43 在部分 PD-L1 表达阴性的肿瘤模型中 (如肝细胞癌) 展现出优异的抗肿瘤疗效。
Phase 1a、1b 研究,也证实了 HLX43 是一款广谱抗肿瘤 ADC。其疗效不依赖患者生物标志物的表达,无论在鳞状 NSCLC,非鳞状 NSCLC,脑转移及非脑转移患者,亦或 EGFR 突变或野生型、PD-L1 阳性或不表达/低表达的人群中,HLX43 都展现了初步的临床疗效。
往前线的治疗,复宏汉霖也已经在推动。据公司透露,HLX43 和公司自主研发的 PD-1 抗体联用临床研究进展顺利并展现出积极的信号。 HLX43 临床研究未来将会往一线甚至新辅助治疗等领域延伸。随着临床研究的持续进展,从耐药患者到全人群的覆盖,PD-L1 ADC 可能以 「老靶点新机制」 的姿态,颠覆市场认知。
一场关于技术的终极对决
当然,谁能最终胜出仍是值得探讨的问题
辉瑞的 PF-08046054 虽在研发进度上具备一定优势,但其作为承接自 SeaGen 的资产,技术短板已逐渐显现。该分子搭载的是第二代 ADC 常用的 MMAE(vedotin) 有效载荷,在疗效层面存在天然劣势;且其连接子稳定性不足,血液毒性较为突出。
也正因此,辉瑞虽对 PD-L1 ADC 赛道寄予厚望,却不得不押注更多分子 —— 其新一代 PD-L1 ADC 药物 PF-08046037 选用 TLR7 激动剂作为有效载荷,但目前仍处于临床前阶段,短期内难以兑现价值。
对于 PD-L1 ADC 而言,技术突破是绕不开的核心命题。复宏汉霖 HLX43 之所以展现出强劲竞争力,源于其从抗体、连接子到载荷、载药量的全链条技术优势
在抗体方面,HLX43 搭载的是复宏汉霖拥有自主 IP 的抗 PD-L1 单抗 HLX20。临床前研究显示,其在结合亲和力、功能活动及药代动力学等方面皆与阿替利珠单抗类似。据文献报道,阿替利珠单抗每三周 (Q3W) 给予 4 mg/kg 的剂量达到的血清稳态浓度可在超过 90% 的患者中实现靶点受体饱和占位。预计 HLX43 在 2.0–3.0 mg/kg Q3W 的剂量范围可达到与阿替利珠单抗 4 mg/kg 相似的受体占领水平,在整个给药间隔期间维持高水平的受体占位。
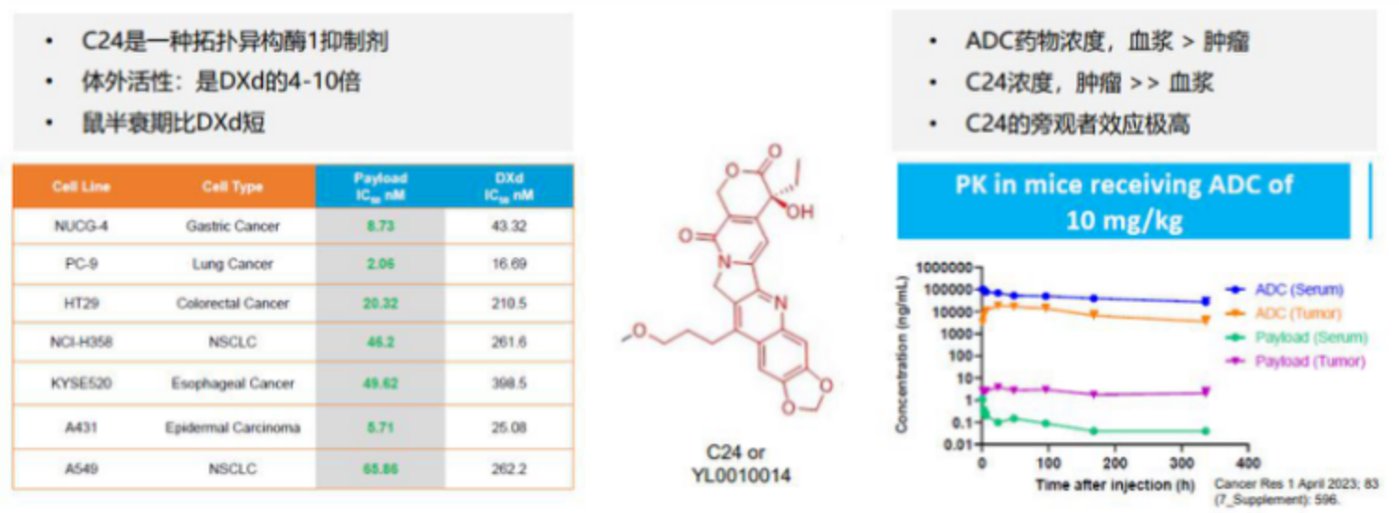
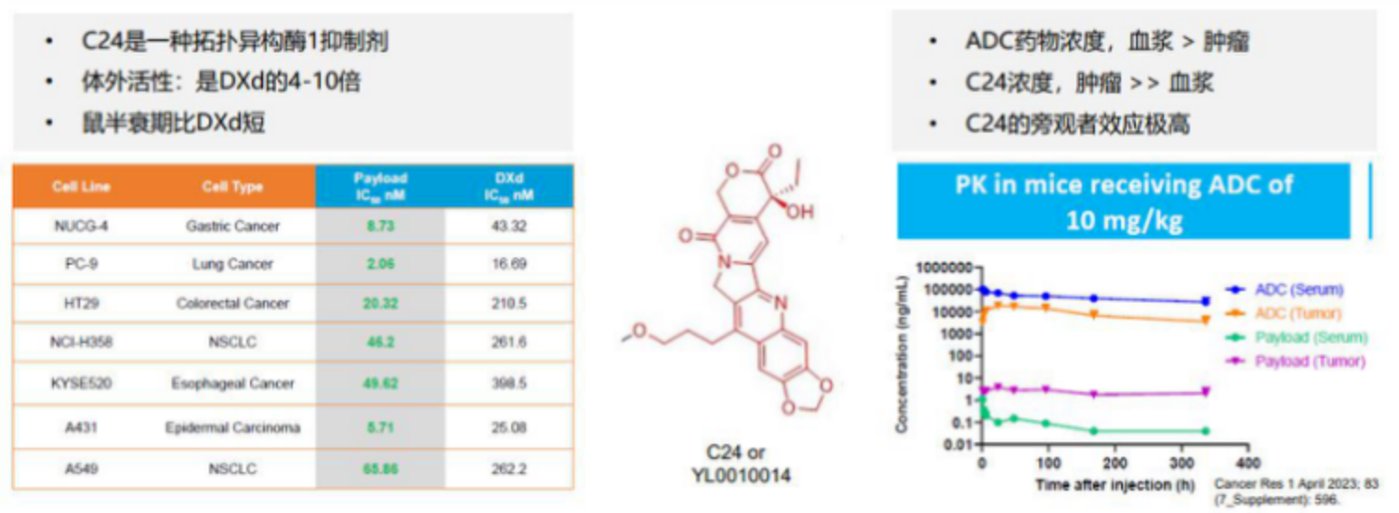
连接子方面,HLX43 选择的是 TMALIN 平台可裂解的三肽连接子,通过半胱氨酸偶联和不可逆接头,在血浆中更稳定,并且可以实现胞内和胞外 TME 的双重释放。这一方面,可以产生旁观者效应实现增效、扩大治疗窗口;另一方面,这也是触达 PD-L1 不表达/低表达的肿瘤患者人群的关键。
毒素方面,HLX43 同样选择了升级,采用新型强效载荷毒素 C24——DNA 拓扑异构酶抑制剂类毒素。与毒素 MMAE 相比,C24 毒性更强且半衰期更短,在高效杀伤肿瘤的同时,确保了较好的安全性。
毒素杀伤力强的同时,HLX43 的 DAR 值约为 8,且具有高度均一性。也就是说,高载药量进一步增强了疗效。
上述技术组合使 HLX43 成为 PD-L1 ADC 赛道的强力 「搅局者」。目前,其研发进度与辉瑞 PF-08046054 高度接近,且已在早期临床中展现出 BIC 潜力,甚至有望弯道超车,冲击 「FIC」 地位。
从辉瑞的多管线押注到复宏汉霖的全链路创新,PD-L1 ADC 赛道正上演一场激烈的 「技术大航海」 对决。期待未来,PD-L1 ADC 上演更多精彩故事。
[ad_2]