9 月 11 日,特朗普政府拟议的创新药制裁方案引发资本市场剧震,港股恒生生物科技指数开盘即暴跌 7%,百济神州、石药集团等龙头企业股价集体重挫。然而不到 48 小时,国家药监局的一则公告为焦虑的市场注入强心剂——创新药临床试验申请审评审批时限压缩至 30 个工作日,较原有周期缩短近一半。
美国试图通过强化 CFIUS 审查、抬高 FDA 数据监管成本的方式,切断中国创新药出海的核心盈利路径。中国则以 「审批提速+全球同步研发申报」 的路径突围,压缩从 IND 到 NDA 的全周期时间,加速临床资源的集聚效应,推动行业资源配置向更高效的创新链条倾斜。
两大条款直指 BD 授权,但行政令仍在 「草稿箱」
据 《纽约时报》9 月 10 日报道,特朗普政府正酝酿的行政令草案包含两大核心条款,精准针对中国以创新药 BD 授权为主的关键环节。
第一重针对来自美国外国投资委员会 (CFIUS) 的审查扩容,要求美国药企收购中国在研药物权益必须接受强制安全审查。
这并非空穴来风,2022 年,凯莱英收购美国 CDMO 企业 Snapdragon 因 CFIUS 阻挠而流产,成为医药行业首起受阻案例,当时的审查逻辑如今正从个案上升为系统性政策。
数据显示,中国创新药对美国市场的依赖度不容小觑。兴业证券研报显示,截至 8 月末,国产创新药已达成 License-out(对外授权) 交易数量 83 项,同比增长 57%;披露总金额达 845.31 亿美元,同比增长 185%,国内药企全球竞争力持续加强。
这些交易中,美国药企是重要的合作方,CFIUS 审查的强化可能导致交易周期延长、成本上升,甚至迫使部分美国企业放弃合作;审查加码也可能削弱中国创新药在国际交易中议价能力。
第二重针对直指药品出海的核心环节。特朗普政府拟要求 FDA 对中国临床数据实施更细致的审查,并对提交中国试验数据的企业收取更高的监管费用。
这会进一步提高中国创新药进入美国市场的门槛。据 《自然》 旗下综述杂志 《自然评论药物发现》 数据统计,2007 年至 2023 年间,总计 177 家中国创新药企业的 350 种创新药在美国开展临床研究,总体来看,从临床Ⅰ期走到 FDA 批准的成功率仅为 1.7%。
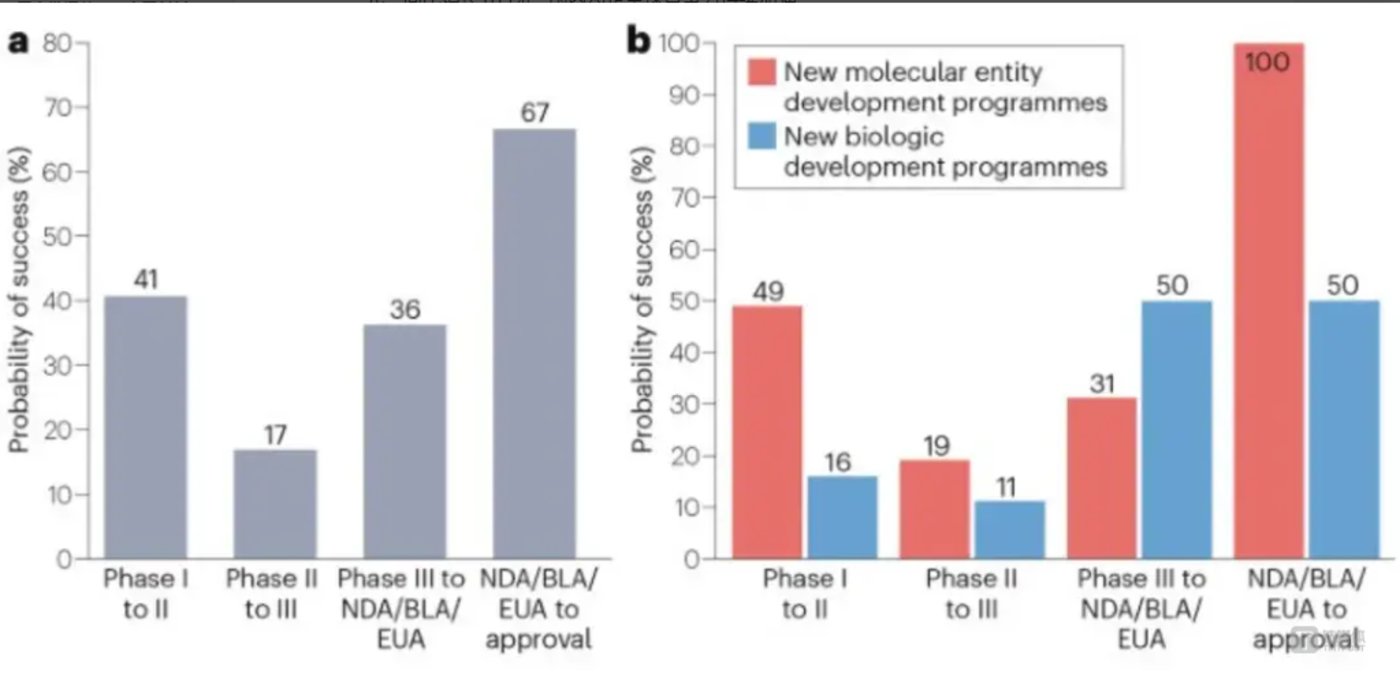
中国创新药在美国临床试验成功情况:a. 各临床阶段成功率;b. 各阶段按药品类型的成功率
目前,中国自主研发的 PD-1 抑制剂中,仅有百济神州的替雷利珠单抗 (美国商品名:TEVIMBRA®) 和君实生物的特瑞普利单抗 (美国商品名:LOQTORZI™) 两款成功获得美国 FDA 批准上市;恒瑞医药的 「双艾」 疗法 (卡瑞利珠单抗联合阿帕替尼) 不得不重新提交申请,足见 FDA 审批的严苛程度。如此额外的审查成本和时间延误,可能让中国创新药在国际竞争中丧失时间窗口优势。
不过,这些动作看似来势汹汹,实则暗藏裂痕。此次草案是与白宫关系密切的知名投资者和企业高管的游说结果,中国创新药企以成本优势和研发效率吸引跨国药企 (MNC) 关注,导致部分美国本土 Biotech 公司在融资、IPO 及并购等方面的利益受到冲击,因此包括科技亿万富翁彼得·蒂尔、谷歌联合创始人谢尔盖·布林等人均主张进行果断打击。
但未来几年,多个 MNC 原有重磅药物独占期陆续结束,面临着上千亿美元的专利悬崖危机,急需引入新的产品管线以维持增长。过去一段时间,包括辉瑞、阿斯利康在内的 MNC 已通过 License-in 或合作开发等方式,从中国引入多个 「便宜又管饱」 的创新药项目,中国管线有着更优的投资回报率。
因此,在行政令草案的相关议题上,美国国内存在明显立场分歧。白宫发言人库什·德赛已迅速回应称 「并未积极考虑该草案」。多家券商机构考虑到特朗普政府执政风格,认为该政策后续不完全落地可能性较大,同时 MNC 等利益集团游说动力强、具体实操难度大,以及出于医学伦理考虑,也会对草案实施形成压力。
中国不止卖管线,还把 IND 从 「季度」 压到 「月份」
在美国制裁阴云密布之际,国家药监局的审评提速政策如定海神针。
根据 9 月 12 日 《关于优化创新药临床试验审评审批有关事项的公告》,国家药监局将符合要求的创新药临床试验申请 (IND) 的审评审批时限,从原来的 60 个工作日压缩至 30 个工作日。通道范围为满足三条标准之一的中药、化学药品、生物制品 1 类创新药临床试验。
2018 年,国家局发布了 《关于调整药物临床试验审评审批程序的公告》,实行临床试验默许制以及 pre-IND 沟通流制度,大大加快了符合要求的创新药 I 期临床试验申请的审评速度。此次增设 30 日通道,是对默许制的进一步优化,把审评效率从 「季度」 压缩到 「月份」。
这一政策将产生多重连锁反应,最直接的影响是研发周期的大幅缩短。在创新药研发 「三个 10」(10 年、10 亿美元、10% 成功率) 的行业定律下,时间就是生命,审评提速能使企业更快推进临床试验,加速产品迭代。
一方面,增强中国在全球研发网络中的吸引力,推动 MNC 将中国纳入早期研发计划,在激烈的国际竞争中抢占先机。另一方面,本土企业拿到临床数据的速度优势,将反向提升在国际交易桌上的议价权,谁拥有更快读出数据的管线,谁就拥有下一轮融资和对外授权的主动权。
更重要的是,这将引导创新药企业在战略布局上形成更清醒的共识——当出海通道可能遇阻时,国内审评效率的提升使本土市场成为更可靠的 「基本盘」。
根据国家药监局统计,2025 年上半年,国内创新药获批数量达 43 个,同比增长 59%,其中国产创新药占比高达 93%。最新统计显示,我国在研新药数量占全球数量比例超过 20%,跃居全球新药研发的第二位,创新药研发上市加速起跑。
从政策方向上看,国家鼓励创新药研发的基调是一直延续的,支持创新药全链条发展的工作部署正逐个落地。
国家医保局 7 月发布的 《支持创新药高质量发展的若干措施》 构建了 「研发+支付」 的全链条支持体系,增设商保创新药目录解决高值药支付难题,医保数据开放助力研发精准定位,完善入院通道保障临床可及性。

特别是 「三除外」 政策 (商保目录药品不计入医保自费率等指标),解除了医疗机构使用创新药的后顾之忧,为加速上市的创新药提供了市场消化渠道。整体而言,通过研发端、准入与支付、临床应用等多个层次的政策组合拳,构建了创新药高质量发展的闭环体系。
政策推动下,从 IND 到 NDA(新药申请),时间差被政策压缩,也加速了临床资源的集聚效应。头部 CRO(合同研究组织) 凭借更成熟的试验管理体系、更高的数据质量把控能力及更充足的 site 资源,能更好承接药企对临床试验提速增效的需求,临床资源或进一步向头部 CRO 集中;同时医保支付端 「简易续约」 降价温和,留给真创新的利润空间反而扩大。
从长远看,中国创新药企需在技术主权与全球合作之间找到新平衡。通过审评提速、医保支持等政策,练出真正技术主权的同时跨出国门,以多元、分散、合规的国际合作网,对冲任何单一市场的制裁风险。全球化仍然是 「必选项」。(本文首发于钛媒体 APP,作者丨曹倩)